Enrique Marcos comenzó el proyecto con el grupo de David Baker de la Universidad de Washington (Seattle, EEUU), expertos a nivel mundial en el diseño computacional
Este es el trabajo que está desarrollando Enrique Marcos, investigador postdoctoral del Instituto de Investigación Biomédica de Barcelona (IRB Barcelona), quien interesado en la aplicación de la computación para hacer ingeniería de nuevas proteínas con funciones diferentes, viajó a Seattle (Estados Unidos) mediante un contrato Marie Curie para trabajar con el grupo de David Baker de la Universidad de Washington, expertos a nivel mundial en esta materia.Enrique Marcos, que ahora continúa el proyecto en el Laboratorio de Modesto Orozco del IRB Barcelona como parte del contrato postdoctoral, ha explicado a SaluDigital cómo hubo un cambio de mentalidad cuando él llegó al grupo de trabajo de Baker.

LIMITACIONES DE LAS NATURALES
De manera tradicional, los investigadores buscaban diseñar una proteína nueva con una función determinada. Lo más común, entonces, era hallar una proteína natural que tuviese una estructura parecida a la función que se quería desarrollar y, a continuación, trazar a través del ordenador las mutaciones pertinentes en la proteína natural para lograr la nueva función que se buscaba.
Modificar proteínas naturales, que cuentan con una geometría única, lleva consigo la pérdida de estabilidad de las mismas, impidiendo encajar con la función concreta que se busca
Sin embargo, esta forma de hacerlo contaba con una serie de limitaciones. Una de ellas es la pérdida de estabilidad que sufre la proteína natural cuando son modificadas debido a que estas han evolucionado con el tiempo para funcionar de manera correcta dentro de un organismo. Por ejemplo, las que tenemos en nuestro cuerpo se han adaptado a nuestra temperatura de 37 º. Pero, según el investigador del IRB, muchas de estas proteínas naturales “no tienen la suficiente estabilidad para tolerar los cambios que requiere la nueva función”.Igualmente, había que tener en cuenta la estructura de estas proteínas. La geometría interna de las naturales “son únicas”, con la dificultad de que es probable que no se llegue a encontrar la geometría o estructura ideal que encaje con la función concreta que se quiera conseguir. Lo que ocurría entonces, es que “había que quedarse con la estructura que puede ser la más cercana, pero no va a ser la óptima para la función”.
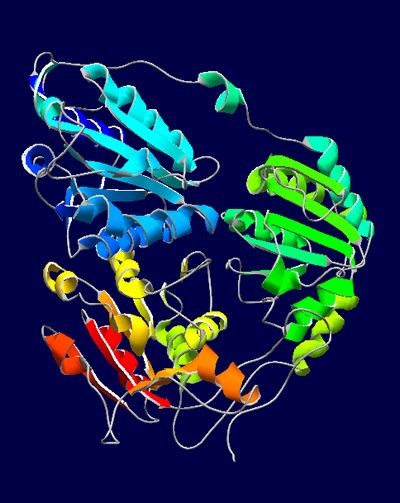
BOLSILLOS PARA UNIR MOLÉCULAS
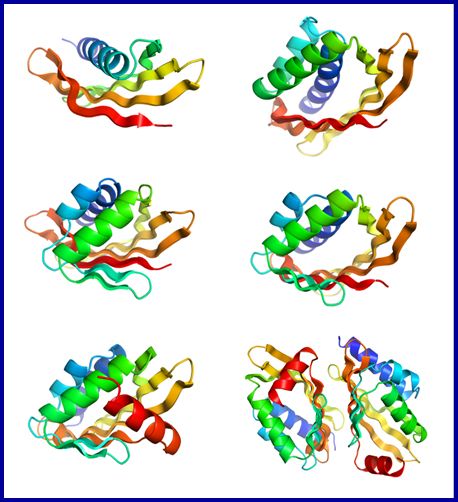
El objetivo concreto del proyecto en el que participa Enrique Marcos, que ha sido publicado en la revista Science, era la creación de proteínas que contaran con cavidades o “bolsillos” que sirvieran para “catalizar reacciones químicas” o en los que se pudiera diseñar sitios para unir moléculas “que nos interese detectar, reconocer o secuestrar”.
Y para conseguir la unión de estas moléculas, comenta el investigador Marcos y como se ha mencionado anteriormente, “es muy importante tener en cuenta la geometría de esos bolsillos donde se va a ubicar la molécula”. Para poder hacerlo, comenta, “los aminoácidos han de estar bien orientados”. Este reto de diseñar proteínas con estas cavidades, como se describe en el artículo del que Enrique Marcos es el primer autor, lo lograron conseguir estos profesionales de la Universidad de Washington.
Diseñar proteínas por ordenador podría utilizarse como tratamiento paralelo o complementario para inhibir o bloquear proteínas implicadas en procesos patológicos
Tras desarrollar la herramienta básica para construir estas proteínas, el siguiente paso, fase que va a desarrollar este investigador en el IRB Barcelona, es seguir construyendo nuevas proteínas con nuevas funciones y testearlas para ver qué aplicaciones se pueden conseguir. No obstante, dicha aplicación “no va a ser inmediata”, se trata de “una fase incipiente”.APLICACIONES MÉDICAS
Este tipo de proteínas, avanza Marcos, podrían ser capaces de detectar moléculas tóxicas que se establezcan en el organismo y que se asocian a algún tipo de enfermedad. En este sentido, el desarrollo de estas proteínas artificiales “va a tener interés de diagnóstico”. Por ejemplo, se pueden diseñar biosensores o sensores basados en biomoléculas “con los que se puedan detectar in situ moléculas que nos interese”. Sobre esta cuestión en concreto, ha mostrado un especial interés la industria farmacéutica.
Otra de las posibles aplicaciones, atendiendo al concepto del diseño de proteínas por ordenador, sería, por ejemplo, utilizarlo para inhibir o bloquear proteínas implicadas en procesos patológicos o sobreexpresadas en cáncer. En este caso, las proteínas de diseño, podrían ser un tipo de tratamiento “paralelo o complementario” a los llamados anticuerpos. Esto, aclara Enrique Marcos, puede proporcionar “actividades muy similares pero que cuente con las ventajas de expresión o estabilidad”, ya que los anticuerpos, normalmente cuentan con poca estabilidad y su producción es lenta y costosa.

