En su laboratorio, todos saben que a Harry Noller, director del Centro de Biología Molecular del RNA de la Universidad de California (en EE UU), le gusta despertar su mañana con café capuchino y un donut de chocolate. “El físico Edward Teller dijo una vez que la ciencia es el proceso de convertir el café en ideas”, cuentan que suele contar este profesor emérito mientras camina de vuelta hacia su oficina. Noller lleva medio siglo estudiando el funcionamiento del ribosoma, orgánulo del citoplasma donde se construyen las proteínas dentro de una célula viva: “Es el encargado de traducir el lenguaje genético para poder ensamblarlas”, explica, “uno de los procesos fundamentales de la vida”.
La entrega de tal distinción se realizó la pasada semana en una gala que reunió a prestigiosos investigadores de todo el mundo. Durante 50 años, Noller se ha esforzado en revelar la estructura del ribosoma y cómo trabaja éste, señalando inesperadamente el papel crucial del ARN. Los resultados tienen importantes aplicaciones prácticas.
RESISTENCIA A LOS ANTIBIÓTICOS
Muchos de los antibióticos más eficaces que conocemos actúan dirigiéndose a los ribosomas bacterianos. Los hallazgos de este investigador han ayudado a desarrollar nuevos y prometedores compuestos para combatir las cepas de bacterias, cada vez más resistentes a la acción antibiótica. Noller empezó a estudiar el ribosoma en Ginebra (Suiza) en 1966. Como estructura biomolecular, el ribosoma resulta enormemente complejo. Se conforma de proteínas y moléculas de ARN intrincadamente dobladas y entrelazadas.
Ya en la Universidad de California, Noller comenzó a barajar la idea de que las proteínas eran componentes activos, mientras que “las moléculas de ARN proporcionan un marco estructural para mantener dichas proteínas en su lugar”. Pero conforme modificaba sistemáticamente las proteínas para bloquear su actividad, el profesor descubrió que el ribosoma continuaba funcionando. Además, Noller asignó a un estudiante de su laboratorio, para que tratase los ribosomas con un producto químico que modificara el ARN. Y los resultados fueron sorprendentes: “El tratamiento había eliminado por primera vez la actividad del ribosoma no inactivando una proteína, sino inactivando el componente de ARN”, detalla el laureado investigador.
El laboratorio que dirige Noller logró en 1999 un gran avance al generar la primera imagen de alta resolución de la estructura molecular de un ribosoma completo. En ese momento, se convirtió en la estructura más grande jamás representada por cristalografía de rayos X. Más adelante, el equipo consiguió imágenes de mayor resolución, algo que posibilitó mostrar detalles nunca vistos del orgánulo y elaborar hipótesis acerca de la forma en que se desplaza el ARN ribosómico durante la síntesis de proteínas.
TRADUCIR EL CÓDIGO
Para ensamblar una nueva proteína, las instrucciones genéticas se copian, primero, de la secuencia de ADN de un gen a una molécula de ARN mensajero. El ribosoma entonces traduce el ARN mensajero, haciendo coincidir cada tripleta de letras del código genético con un bloque de construcción específico de proteína (uno de los 20 aminoácidos). Así el ribosoma sintetiza una molécula de proteína con la secuencia exacta de aminoácidos especificada por el gen.
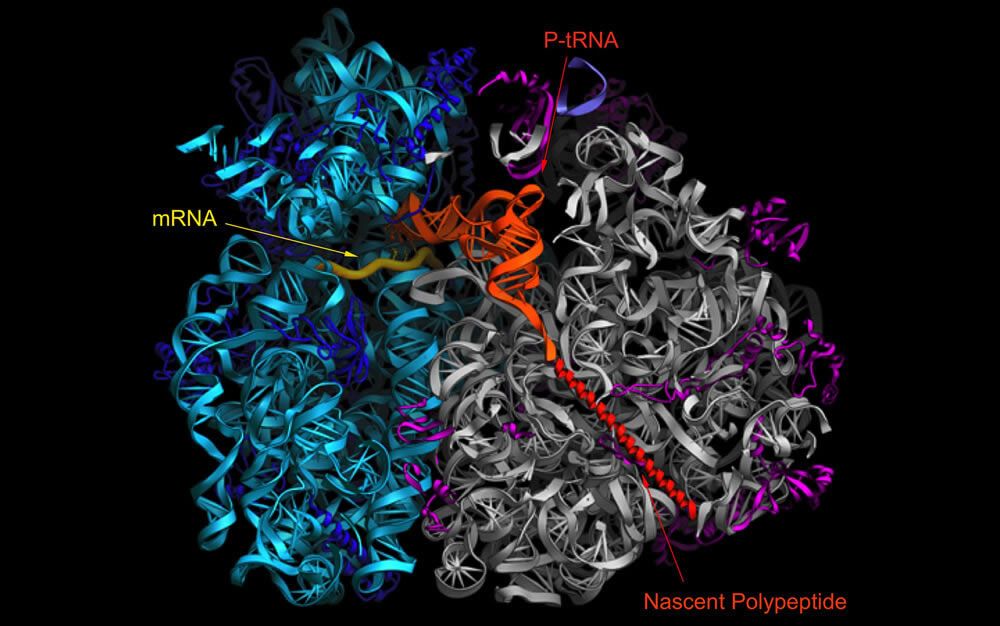
La adaptación de los codones a los aminoácidos se realiza a través de moléculas de ARN de transferencia. Cada una transporta hasta el ribosoma un aminoácido específico y lo alinea con la tripleta coincidente del ARN mensajero. Las imágenes obtenidas por el grupo de Noller muestran el ribosoma completo con un ARN mensajero y dos ARN de transferencia de longitud completa unidos a él. Además, su equipo ha logrado congelar el ribosoma en acción durante diferentes etapas del proceso de traducción, produciendo una serie de instantáneas del orgánulo en funcionamiento.
ORIGEN DE LA VIDA
El papel que desempeña el ARN en la actividad del ribosoma abre la puerta para que quizás algún día lleguemos a saber cómo surgieron las primeras proteínas si las proteínas son moléculas activas y se requiere de ellas para confeccionar otras nuevas. Noller cree posible que los ribosomas “inaugurales” estuviesen compuestos enteramente de ARN.
Cuando el premio Nobel de Química 2009 fue entregado a un trío de científicos por su trabajo sobre la estructura del ribosoma, muchos compañeros lamentaron que Harry Noller no recibiera idéntico honor (las reglas de la academia sueca limitan cada galardón a no más de tres destinatarios). Los premios Breakthrough sí han reconocido al científico por su dilatada y exitosa carrera. Aunque él sigue despertando sus mañanas con café capuchino y donuts de chocolate. Es otro día más en el laboratorio, desentrañando el ribosoma.
Noller ha puesto de manifiesto la centralidad del ARN en la formación de los centros activos del ribosoma
En su quinta edición, los premiosBreakthrough (instaurados por el cofundador de Google, Sergey Brin, y el CEO de la red social Facebook, Mark Zuckerberg, para festejar las mejores investigaciones y carreras científicas) han querido celebrar la exitosa trayectoria profesional de Noller y han entregado al científico norteamericano el galardón ‘Avance en Ciencias de la Vida 2017', dotado con tres millones de dólares. En palabras del jurado: “Noller ha puesto de manifiesto la centralidad del ARN en la formación de los centros activos del ribosoma, maquinaria fundamental de la síntesis de proteínas en todas las células; conectando así la biología moderna al origen de la vida y también explicando cuántos antibióticos naturales interrumpen la síntesis de proteínas”.La entrega de tal distinción se realizó la pasada semana en una gala que reunió a prestigiosos investigadores de todo el mundo. Durante 50 años, Noller se ha esforzado en revelar la estructura del ribosoma y cómo trabaja éste, señalando inesperadamente el papel crucial del ARN. Los resultados tienen importantes aplicaciones prácticas.
RESISTENCIA A LOS ANTIBIÓTICOS
Muchos de los antibióticos más eficaces que conocemos actúan dirigiéndose a los ribosomas bacterianos. Los hallazgos de este investigador han ayudado a desarrollar nuevos y prometedores compuestos para combatir las cepas de bacterias, cada vez más resistentes a la acción antibiótica. Noller empezó a estudiar el ribosoma en Ginebra (Suiza) en 1966. Como estructura biomolecular, el ribosoma resulta enormemente complejo. Se conforma de proteínas y moléculas de ARN intrincadamente dobladas y entrelazadas.
Ya en la Universidad de California, Noller comenzó a barajar la idea de que las proteínas eran componentes activos, mientras que “las moléculas de ARN proporcionan un marco estructural para mantener dichas proteínas en su lugar”. Pero conforme modificaba sistemáticamente las proteínas para bloquear su actividad, el profesor descubrió que el ribosoma continuaba funcionando. Además, Noller asignó a un estudiante de su laboratorio, para que tratase los ribosomas con un producto químico que modificara el ARN. Y los resultados fueron sorprendentes: “El tratamiento había eliminado por primera vez la actividad del ribosoma no inactivando una proteína, sino inactivando el componente de ARN”, detalla el laureado investigador.
En 1972, su propuesta de que el ARN era el componente activo del ribosoma fue rechazada por la mayoría de investigadores
Cuando se hicieron públicos estos resultados en 1972, su propuesta de que el ARN era el componente activo del ribosoma fue rechazada por la mayoría de los investigadores en el campo. “Ahora, en cambio, es el paradigma aceptado”, sonríe Noller. El descubrimiento durante la década de los 80 de las ribozimas (moléculas de ARN que catalizan reacciones bioquímicas) contribuyó a su aceptación. Sin embargo, para entender realmente cómo funciona el ribosoma, “resultaba esencial obtener un cuadro detallado de su estructura molecular”. El procedimiento estándar para esto es la cristalografía de rayos X, la cual requiere cristales puros pertenecientes a la estructura molecular. El laboratorio que dirige Noller logró en 1999 un gran avance al generar la primera imagen de alta resolución de la estructura molecular de un ribosoma completo. En ese momento, se convirtió en la estructura más grande jamás representada por cristalografía de rayos X. Más adelante, el equipo consiguió imágenes de mayor resolución, algo que posibilitó mostrar detalles nunca vistos del orgánulo y elaborar hipótesis acerca de la forma en que se desplaza el ARN ribosómico durante la síntesis de proteínas.
TRADUCIR EL CÓDIGO
Para ensamblar una nueva proteína, las instrucciones genéticas se copian, primero, de la secuencia de ADN de un gen a una molécula de ARN mensajero. El ribosoma entonces traduce el ARN mensajero, haciendo coincidir cada tripleta de letras del código genético con un bloque de construcción específico de proteína (uno de los 20 aminoácidos). Así el ribosoma sintetiza una molécula de proteína con la secuencia exacta de aminoácidos especificada por el gen.
La adaptación de los codones a los aminoácidos se realiza a través de moléculas de ARN de transferencia. Cada una transporta hasta el ribosoma un aminoácido específico y lo alinea con la tripleta coincidente del ARN mensajero. Las imágenes obtenidas por el grupo de Noller muestran el ribosoma completo con un ARN mensajero y dos ARN de transferencia de longitud completa unidos a él. Además, su equipo ha logrado congelar el ribosoma en acción durante diferentes etapas del proceso de traducción, produciendo una serie de instantáneas del orgánulo en funcionamiento.
ORIGEN DE LA VIDA
El papel que desempeña el ARN en la actividad del ribosoma abre la puerta para que quizás algún día lleguemos a saber cómo surgieron las primeras proteínas si las proteínas son moléculas activas y se requiere de ellas para confeccionar otras nuevas. Noller cree posible que los ribosomas “inaugurales” estuviesen compuestos enteramente de ARN.
Para ensamblar una nueva proteína, las instrucciones genéticas se copian de la secuencia de ADN de un gen a una molécula de ARN mensajero
El descubrimiento de que las moléculas de ARN pueden codificar información genética, hacer copias y catalizar reacciones bioquímicas ha llevado a la comunidad científica a preguntarse si la vida arrancó con moléculas de ARN autorreplicantes. En estos momentos, los investigadores intentan averiguar cómo el ARN podría entonces haber brotado de los productos químicos no vivientes en la Tierra primitiva. “Tal vez la cuestión última pasa por cuestionarnos, ¿de dónde venimos?”, apunta el investigador. Cuando el premio Nobel de Química 2009 fue entregado a un trío de científicos por su trabajo sobre la estructura del ribosoma, muchos compañeros lamentaron que Harry Noller no recibiera idéntico honor (las reglas de la academia sueca limitan cada galardón a no más de tres destinatarios). Los premios Breakthrough sí han reconocido al científico por su dilatada y exitosa carrera. Aunque él sigue despertando sus mañanas con café capuchino y donuts de chocolate. Es otro día más en el laboratorio, desentrañando el ribosoma.