Con el objetivo de diagnosticar precozmente la enfermedad de Alzheimer, que afecta a unas 800.000 personas en España y se calcula que en unos 30 años la padecerán unos 50 millones en los países desarrollados, trabaja el grupo de investigadores que lidera el Dr. Francisco J. Muñoz, director de la cátedra de la Fundación QUAES (impulsada por Cetir Ascires) en la Universitat Pompeu Fabra de Barcelona. Como principal hallazgo, han identificado nuevos genes que pueden estar actuando como protectores frente al alzhéimer, lo que posibilita explorar nuevas vías para el tratamiento de la enfermedad.
Esta terrible enfermedad está relacionada con una proteína de pequeño tamaño conocida como el péptido b-amiloide, que liberan las neuronas y que, con la edad, comienza a acumularse dentro del cerebro, llegando a tener un efecto neurotóxico. Hasta el momento no se han conseguido terapias suficientemente relevantes que impidan la producción de dicha molécula, ni tampoco ha fructificado el uso de fármacos que eviten la acumulación de estos péptidos ni que disminuyan su neurotoxicidad.
"El resultado es una muestra de nuevos genes que pueden estar actuando como protectores frente al Alzheimer o, por el contrario, como activadores de la toxicidad del amiloide"
“Hemos participado cinco grupos internacionales de investigación de la Unión Europea, en el marco de un proyecto ERA-NET (Horizonte 2020), analizando más de 300 proteínas durante dos años. El resultado es una muestra de nuevos genes que pueden estar actuando como protectores frente al alzhéimer o, por el contrario, como activadores de la toxicidad del amiloide (Ab), pudiendo modificar el inicio y la progresión de la enfermedad”, afirma el Dr. Muñoz.
En concreto, el estudio se ha elaborado a partir de una colección de más de cinco mil colonias de levaduras de la especie Saccharomyces cerevisiae. Posteriormente, se modificaron genéticamente y se seccionaron para cruzarlas con otras que sí tenían genes activados para producir la proteína Ab. Gracias a este procedimiento, encontraron que 81 genes similares a los de los humanos aumentaron la toxicidad del Ab y que 157 genes fueron protectores frente a él. A continuación, realizaron un estudio bioinformático identificando cuáles eran las principales funciones celulares neuronales que se afectaban por el péptido, que pasan por: la regulación del calcio intracelular; la traducción de proteínas; y la actividad mitocondrial. Finalmente, la investigación se centró en el estudio de una proteína (SURF4) que regula la entrada de calcio desde el exterior celular en las neuronas humanas y que parece favorecer el daño provocado por elb-amiloideen la enfermedad de Alzheimer.
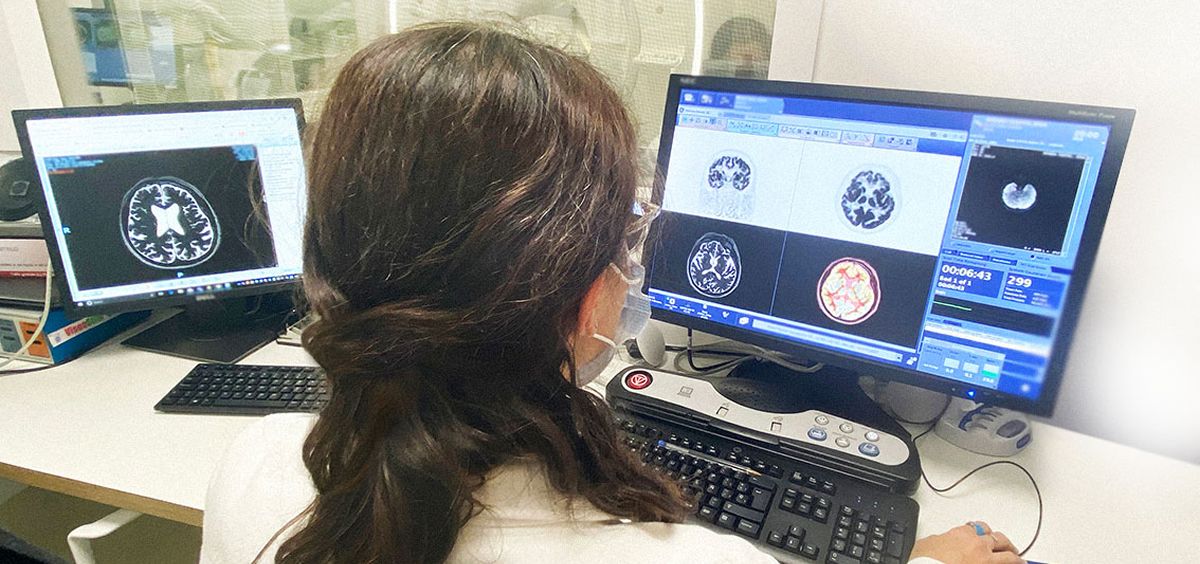
DIAGNÓSTICO POR IMAGEN
Los investigadores resaltan que el estudio de imagen molecular permite identificar precozmente alteraciones morfometabólicas cerebrales que se producen en pacientes con la enfermedad de Alzheimer. Para ello, es necesario disponer de equipos de última tecnología como el PET/RM para identificar y cuantificar variables esenciales para el estudio del alzhéimer y de otras enfermedades neurodegenerativas. Esta técnica híbrida facilita, de forma sincrónica, fusionar la imagen estructural de la Resonancia Magnética (RM) con la imagen metabólica de la Tomografía por Emisión de Positrones (PET), lo que resulta ideal para el estudio de la enfermedad neurodegenerativa, proporcionando la máxima información en un tiempo récord.
“Un abordaje completo que nos permite analizar distintas áreas cerebrales integrando, de forma simultánea, la información que nos proporcionan los biomarcadores de imageny de metabolismo cerebral con los análisis complementarios de cuantificación mediante inteligencia artificial”, concluye el Dr. Eduard Riera, coordinador de medicina nuclear de Cetir Ascires.