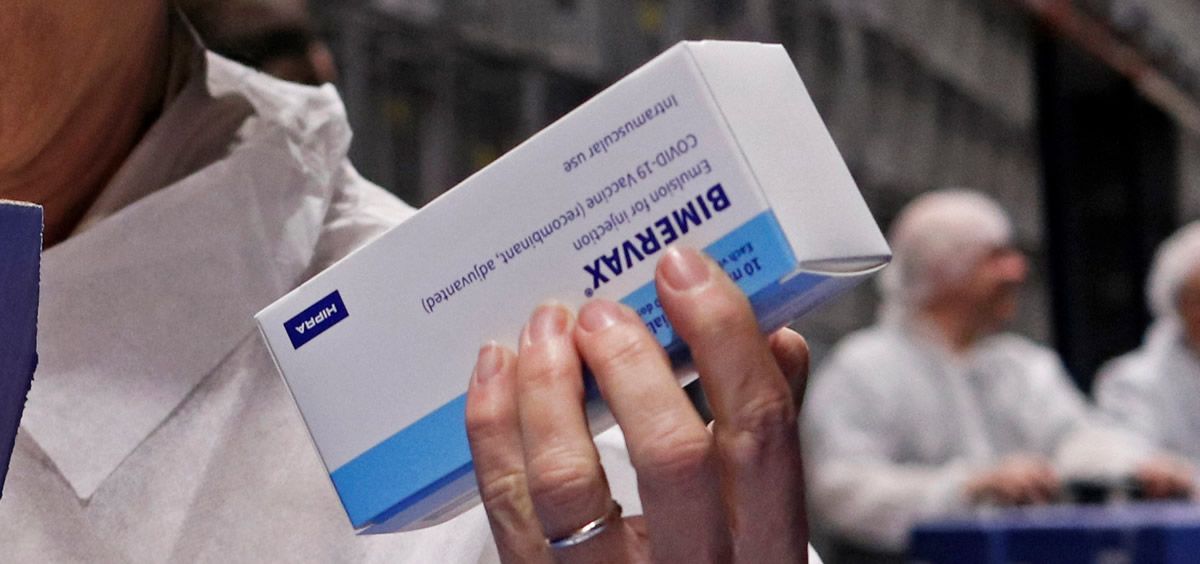
HIPRA, la empresa farmacéutica española, ha entregado oficialmente a la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) los 3,2 millones de dosis de Bimervax adquiridas.
Esta vacuna ha llevado un largo recorrido a lo largo de los últimos meses. El pasado 30 de marzo, la Agencia Europea del Medicamento (EMA) recomendó que se otorgara una autorización de comercialización condicional Bimervax, vacuna frente a la COVID-19 desarrollada por la empresa farmacéutica biotecnológica HIPRA, asentada en Amer (Girona), tras haber completado la evaluación científica iniciada el 20 de marzo.
Un día después, el 31 de marzo, la Comisión Europea (CE) autorizó la comercialización de esta vacuna, para que pueda distribuirse en todos los Estados miembro de la UE, como sucede con el resto de medicamentos autorizados por procedimiento centralizado.
Según se ha informado desde la farmacéutica, la vacuna de HIPRA está indicada como dosis de refuerzo o ‘booster’ para aquellas personas, a partir de 16 años, que hayan recibido la pauta de primovacunación con una vacuna de ARNm, al menos 6 meses después de la última dosis de una vacuna recibida.
El 31 de marzo, la Comisión Europea (CE) autorizó la comercialización de esta vacuna
Bimervax está basada en una proteína recombinante heterodimérica que contiene el sitio de unión al receptor de la proteína S de las variantes alfa y beta del SARS-CoV-2, con lo que contiene información para inducir una respuesta en forma de anticuerpos contra dos variantes del virus. Asimismo, este antígeno está acompañado de un adyuvante que incrementa la respuesta inmune.
El principal estudio realizado con Bimervax es un ensayo clínico que comparó la respuesta inmunitaria de esta nueva vacuna con la desencadenada por la vacuna de ARNm autorizada Comirnaty, de BioNTech/Pfizer contra el SARS-CoV-2 en su variante original (Wuhan); ensayo que recibió el visto bueno de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) el pasado 1 de febrero de 2022.
Cabe recordar que, para su evaluación, también se presentaron datos intermedios de otro ensayo clínico en curso que incluyó a 36 adolescentes de 16 a 17 años. Este estudio reveló que la vacuna de Hipra, administrada como ‘booster’ produce una respuesta inmunitaria adecuada en estos adolescentes, con una producción de anticuerpos comparable a la observada en adultos.