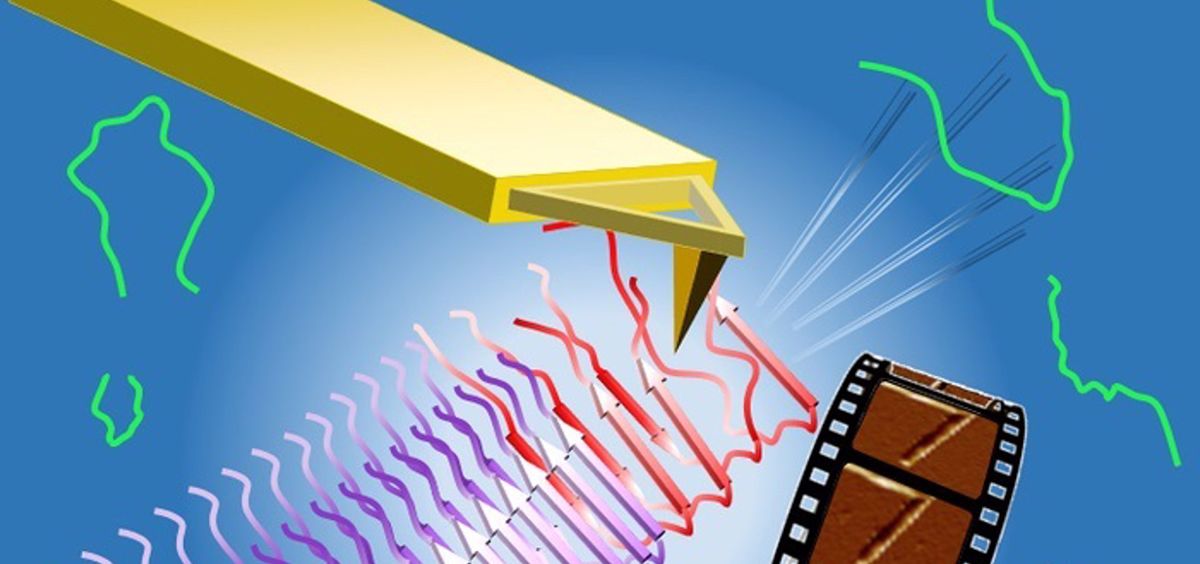
Los avances en el tratamiento de la enfermedad de Alzheimer han sido frustrantemente lentos, pero un grupo de científicos han hallado un posible nuevo camino hacia el tratamiento. Usando modelos computacionales y experimentos con microscopios de fuerza atómica, han identificado un posible talón de Aquiles en la frustración de los péptidos beta amiloides cuando se acoplan a las fibrillas que forman placas en pacientes con Alzheimer.
Según publican en la revista 'Proceedings of the National Academy of Sciences', los pasos frustrados podrían abrir una ventana para medicamentos capaces de tapar los extremos de las fibrillas, evitando una mayor agregación.
Investigadores de la Universidad de Houston (UH) y de la Universidad de Rice, asociados con el Centro de Física Biológica Teórica (CTBP), con sede en Rice, descubrieron mediante experimentos y cálculos que los péptidos beta amiloides, pequeñas moléculas que abundan en el cerebro, pasan por varias etapas intermedias de frustración mientras se "acoplan y bloquean" a las puntas de las fibrillas en crecimiento.
La nueva investigación muestra que podrían desarrollarse fármacos que aprovechen los frustrados estados intermedios de los péptidos para estabilizar las puntas de las fibrillas y bloquear su posterior agregación
Las proteínas que se pliegan tienden a buscar el camino más fácil para llegar a sus formas funcionales. Del mismo modo, los péptidos beta amiloides buscan la forma más fácil de unirse a las puntas de las fibrillas en crecimiento, pero a veces se ven frenados -o frustrados- cuando las fuerzas positivas y negativas entre los átomos no se alinean inmediatamente.
Cuando finalmente se alinean, las fibrillas crecientes forman las placas gomosas implicadas en el Alzheimer y otras enfermedades neurológicas. La nueva investigación muestra que podrían desarrollarse fármacos que aprovechen los frustrados estados intermedios de los péptidos para estabilizar las puntas de las fibrillas y bloquear su posterior agregación.
El ingeniero químico y biomolecular de la UH, Peter Vekilov, señala que no era una exageración observar el crecimiento de las fibrillas de beta amiloide en su laboratorio. "Los estudios anteriores que observaban las proteínas que se fibrilan con un microscopio de fuerza atómica se centraban en comportamientos más exóticos porque las fibrillas beta amiloides con un ritmo de crecimiento constante son algo aburridas", explica. "Pero me fascinó porque la correlación de la tasa de crecimiento con la concentración de péptidos en la solución conlleva mucha información", destaca Vekilov. "Ayuda a medir la constante de velocidad, una cantidad que es fácil de modelizar".
El físico de la Universidad de Rice Peter Wolynes, cuyo laboratorio se especializa en la construcción de modelos informáticos de plegado de proteínas y cromosomas, sugirió que interrumpir el crecimiento constante con urea, conocida por desnaturalizar (o desdoblar) las proteínas, podría proporcionar datos útiles sobre cómo se forman las fibrillas amiloides, y así fue.
"La punta de la fibrilla es un talón de Aquiles de la fibrilarización, y todo lo que tenemos que hacer es bloquear el complejo en la punta"
"Sucedió algo extraño", recuerda Vekilov. La urea "hizo que las fibrillas fueran menos estables, lo que significa que los enlaces entre las moléculas de las fibrillas se hicieron menos fuertes. Pero también las hizo crecer más rápido. Esto es una contradicción muy grave, una violación de las reglas empíricas de la química. Pero hay reglas empíricas, y luego hay leyes fundamentales. Pensamos que esto está tratando de decirnos algo".
Otros experimentos demostraron que la urea "desestabilizaba los enlaces peptídicos erróneos", añade. "Hizo que la fibrilla creciera más rápido, pero también nos mostró los pasos intermedios frustrados. Lo más importante es que ahora tenemos pruebas de que al final de la fibrilla hay una corona de cadenas peptídicas frustradas y desordenadas que intentan acoplarse y bloquearse, y éstas son objetivos farmacéuticos".
"Es irracional bloquear todos los péptidos, porque probablemente hay 100.000 veces más que puntas de fibrillas", continúa. "La belleza de lo que hemos encontrado es que la punta de la fibrilla es un talón de Aquiles de la fibrilarización, y todo lo que tenemos que hacer es bloquear el complejo en la punta".
Wolynes señala que había indicios de frustración en un estudio anterior en el que se observaban indicios de enganche en la agregación de fibrillas. "De los experimentos han surgido dos cosas", explica. "Una es que casi todos los modelos cinéticos que se utilizan para el crecimiento de la beta amiloide son demasiado simples. Eso no es inesperado. La otra es que la desnaturalización cambia el equilibrio, y también puede cambiar la tasa de plegado en formas que indican dónde aparecen los estados de transición".
Tener una forma de detener el crecimiento de las fibrillas podría ayudar a resolver un antiguo desacuerdo entre los científicos sobre si las fibrillas causan enfermedades neurológicas o protegen al cerebro de otro sospechoso
"En el anterior artículo sobre la nucleación de fibrillas, comentamos que parecía que había algunos procesos extraños en los que las proteínas tenían que retroceder desde el estado de transición", recuerda Wolynes. "Así que Peter fue a investigar esto, y creo que es la primera persona en hacerlo".
Según explica, tener una forma de detener el crecimiento de las fibrillas podría ayudar a resolver un antiguo desacuerdo entre los científicos sobre si las fibrillas causan enfermedades neurológicas o protegen al cerebro de otro sospechoso, en particular las proteínas tau enredadas. "Nuestra idea es envenenar la punta para que no pueda crecer, en lugar de desestabilizar toda la fibrilla", señala. "Esto, por supuesto, entra en la gran discusión sobre si las fibrillas son buenas o malas".
Los modelos computacionales podrían demostrar que detener las fibrillas podría frenar los efectos del Alzheimer o empeorarlos. En cualquier caso, Wolynes apunta que los científicos tendrán una respuesta más definitiva. "En mi opinión, lo interesante aquí es proporcionar una nueva diana, y exploraremos algunos posibles fármacos que podrían cambiar la naturaleza de la punta", subraya. En cualquier caso, "esas moléculas proporcionarán herramientas interesantes para entender cómo se produce el crecimiento de las fibrillas".